داروسازی با چاشنی IVD

بررسی همکاری متقابل صنعت داروسازی با صنعت IVD
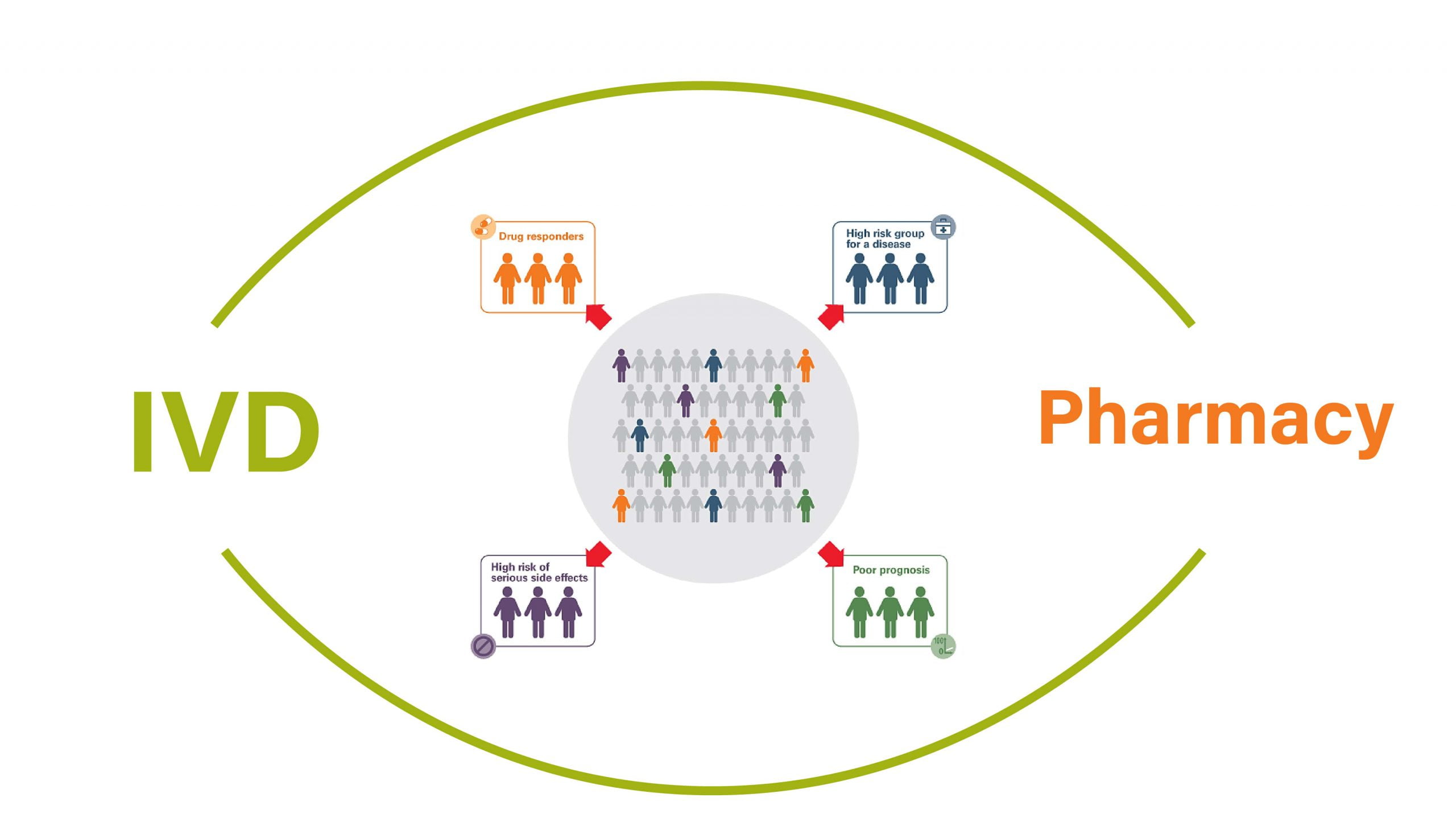
وقتی یک داروی مشخص وارد بازار میشود برحسب پاسخ افراد به این دارو با گروههای متفاوتی روبرو میشویم:
یک گروه (drug responders) کسانی هستند که با مصرف دارو بهبودی کامل کسب میکنند. بدون اینکه مشکلی در روند درمان آنها مشاهده شود.
گروه دوم (high risk group for a disease) کسانی هستند که مشخص شده است. در جریان یک بیماری بیشترین خطر ابتلا را دارند. به طور مثال در دوران بیماری کووید 19 مشخص شده است. که افراد مبتلا به لوپوس در برابر این بیماری بسیار آسیب پذیرترند و داروهای موجود و دردسترس بازار برای لوپوس به بهبود آنها در این شرایط کمکی نمیکند.
گروه سوم (high risk of serious side effects) افرادی هستند که عوارض جانبی شدیدی به داروی عرضهشده نشان میدهند. و قادر به استفاده جدی از دارو برای درمان نیستند.
و گروه آخر (poor prognosis) افرادی هستند که امید کمی به بهبود آنها از بیماری است. و استفاده از داروها برای آنها بیفایده است.
IVD با در نظر گرفتن این شرایط به دنبال ایجاد راه حلهای دارویی مفید برای آنهاست. و این اتفاق میسر نمیشود مگر آنکه استفاده و طراحی دارو با یک دستگاه تشخیصی همراه شود.
مسیرهایی که صنعت تشخیص برای داروسازی ایجاد کرده است، چنان راهگشا بوده که امروزه FDA به داروسازان و جامعه تشخیصی پیشنهاد میدهد که برای تولید یک محصول به اصطلاح “دارو/تشخیص” با هم همکاری کنند تا به یک نتیجه مطلوب برسند.
این مطلب میتواند به توسعه ایدههای شما برای ساخت یک داروی موثرترکمک کند و ذهن شما را از سمت و سوی داروسازی سنتی به طراحی و تولید داروهای مدرن سوق دهد.
صنعت دارو، گذشته از نیاز همیشگی برای طراحی دارو با روشهای سنتی و روشهای بیوانفورماتیکی و ادغام این دو، راههای نرفته بسیاری پیشرو دارد. به نظر میرسد توجه به IVD در مسیر طراحی و تولید دارو، امتیازات بسیاری به ارمغان خواهد آورد.
در این مقاله نقاط عطف همکاری این دو صنعت را بررسی خواهیم کرد.
رابطه صنعت IVD و صنعت دارو: چه دلایلی باعث ایجاد این همکاری شده است؟
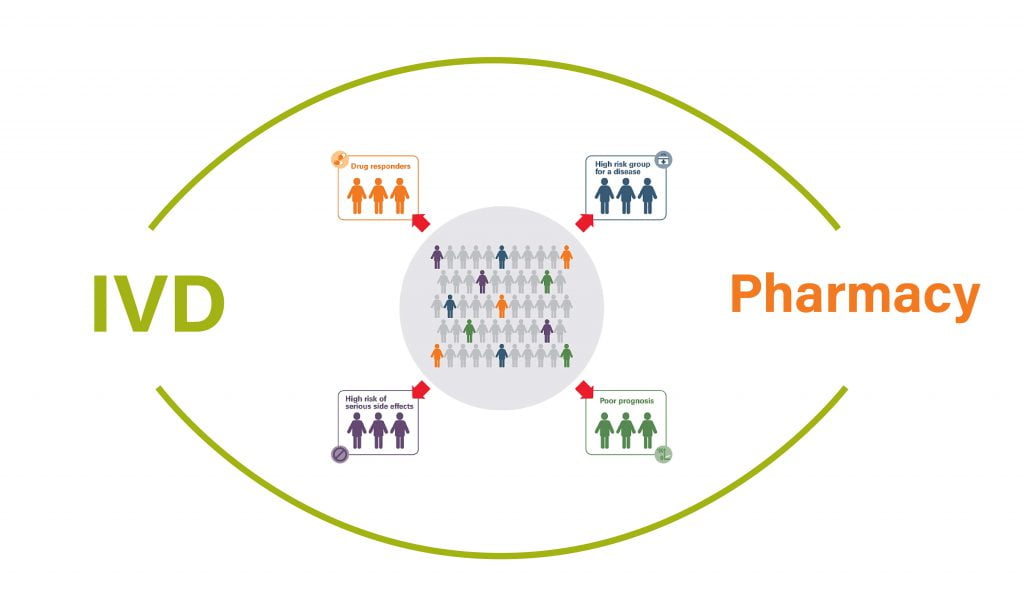
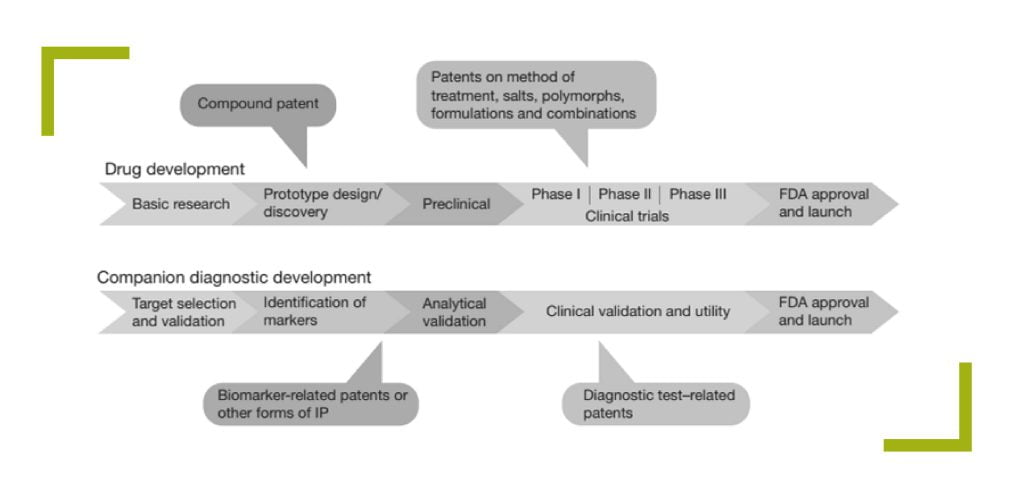
در تصویر بالا حوزههایی که صنعت تشخیص برای پیشبرد صفر تا صد تولید یک کیت یا دستگاه تشخیصی در همکاری با صنعت داروسازی نیاز دارد نشان داده شده است. به طور مثال برای تولید یک کیت مکمل باید برای تشخیص بیومارکرها با آزمایشگاههای R&D همکاری ایجاد شود تا بیومارکر مناسب انتخاب شود. مرحله بالینی با موفقیت طی شود و ادعاهای تشخیصی دستگاه اثبات شود و در نهایت برای صنعتیشدن و گرفتن تاییدیههای لازم اقدام شود.


این تصویر در ستونهای عمودی مراحلی که دو صنعت به طور جداگانه باید طی کنند تا به محصول نهایی برسد را نشان داده است و رابطه افقی به وجود آمده نشاندهنده این است که چگونه مرحله یک از دو صنعت با یکدیگر در ارتباط است و به پیشبرد مسیر یکدیگر کمک میکنند. در واقع عبارتهای افقی روبروی هم نشاندهنده ارتباط موثر دو صنعت در همکاری با یگدیگر است.
داروسازی با یا بدون روشهای تشخیصی؟
مفهوم عملکرد همسو:
یکی از بزرگترین چالشها برای توسعه روشهای درمانی در آینده، همسوکردن حوزههای مرتبط با درمان است. برای همسوسازی صنعت طراحی دارو و صنعت IVD روشهایی به اجرا درآمده است که با مفهوم companion diagnosis و complementary diagnosis قابل شناسایی است.
در روند طراحی و تولید یک داروی جدید، با طیشدن مراحل پیش بالینی، به مرحله عرضه بالینی دارو میرسیم. شرکتهای تولیدی به تولید انبوه میپردازند و در نهایت استفاده دارو در سطح جامعه فراگیر میشود. در این مرحله گاهی حساسیتهای دارویی و تداخلات دارویی که برای بسیاری از بیماران رخ میدهد، در نهایت منجر به حذفشدن دارو و خروج دارو از لیست تجویز پزشکان میشود. بنابراین شرکتهای تولیدکننده این داروها متحمل خسارات جبرانناپذیری میشوند.
اگر در مرحله بالینی، افراد مختلف در برابر داروی مورد نظر پاسخهای متفاوتی به دارو بدهند و مشخص شود که این دارو طیف اندکی از بیماران را بهبود میبخشد، استفادهکنندگان به حداقل می¬رسند و مابقی بیماران به دلیل ناکارآمدی دارو در اثر ایجاد حساسیت، تداخل دارویی یا اثر بخشی کم، تصمیم به ترک دارو گرفته و نهایتا در پی جستجو برای داروی جایگزین میروند.
سوالی که مطرح میشود این است، چرا پیشبرد بازار دارو از طریق تستهای تشخیصی توصیه میشود؟
آیا دلایل کافی داریم تا صنعت طراحی و تولید دارو را به تولید اختصاصی دارو برای یک جامعه هدف خاص سوق دهیم؟
به دنبال چه نوعی از روش تشخیصی هستیم که پاسخگوی این نیاز باشد؟
همچنین بیماران مختلف ممکن است برای درمان بیماری خود به درمانهای متفاوتی نیاز داشته باشند، اما چگونه میتوان فهمید که کدام بیمار به کدام درمان نیاز دارد؟
اینجاست که IVD به کمک ما میآید.
بررسی دو حوزه companion diagnosis و complementary diagnosis
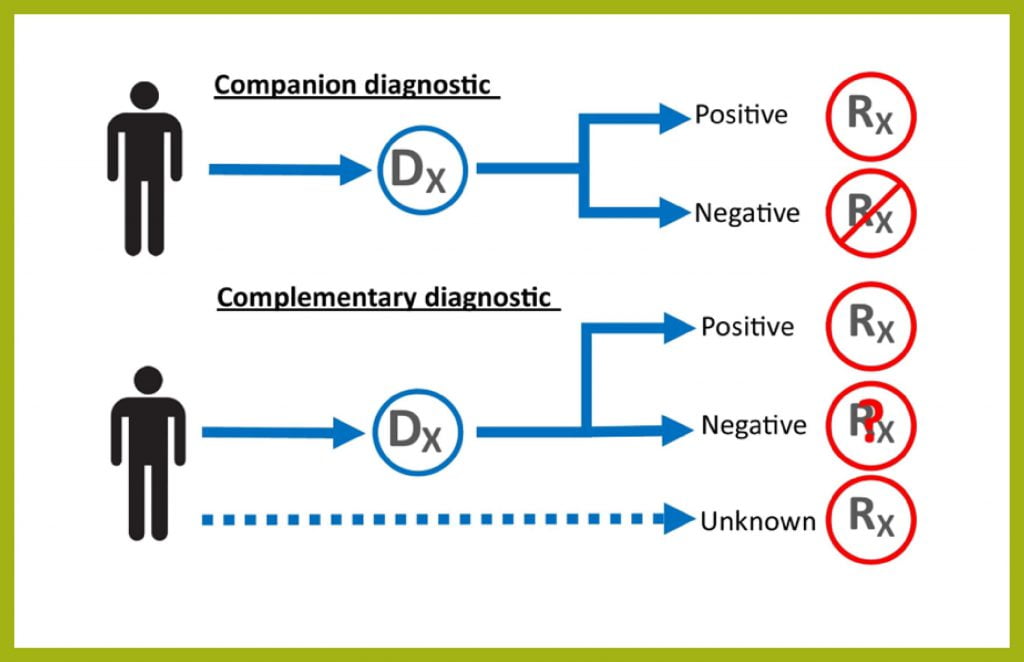
Dx بیانگر یک drug development تعریف شده است که به یک(Rx) Response مشخص میانجامد.
companion diagnosis یا تشخیص مکمل به روشهای تشخیصی خاصی اتلاق میشود. که اطلاعاتی را که ارائه میدهند که برای استفاده ایمن و مؤثر از دارو یا محصول بیولوژیکی مربوطه ضروری است را ارائه میدهند. companion diagnosis یک تشخیص مکمل آزمایشی است. که به تصمیمگیری درمورد انتخاب براساس سود و زیان محصول در جایی که تفاوت بین سود و زیان از نظر بالینی معنیدار باشد کمک میکند.
در تشخیص همراه (complementary diagnosis) و تشخیص مکمل، همواره تجویز دارو مطابق با تشخیص، منجر به پذیرفتهشدن یک داروی خاص از بین داروهای محتمل دیگر میشود. در واقع صنعت تشخیص مشخص میکند که کدام یک از داروها در حوزه درمان موفقتر عمل میکند.
به عنوان مثال، یک آزمایش تشخیصی، نشان میدهد که آیا تومور بیمار دارای یک ژن جهشیافته یا نشانگر زیستی خاص است که توسط دارو مورد هدف قرار بگیرد یا خیر. این به تعیین اینکه آیا بیمار باید دارو را دریافت کند یا خیر کمک میکند.
در همین راستا موفقیت تجاری داروهایی مثل Gleevec® (imatinib) و Herceptin® (trastuzumab) را مدیون تشخیص همراه میدانند. هر دو دارو برای درمان هدفمند سرطان طراحی شده بودند و تشخیص همراه قبل از تجویز اصلی، این دو داروها را به پرفروشترین داروهای درمان سرطان در سال 2015 تبدیل کرد.
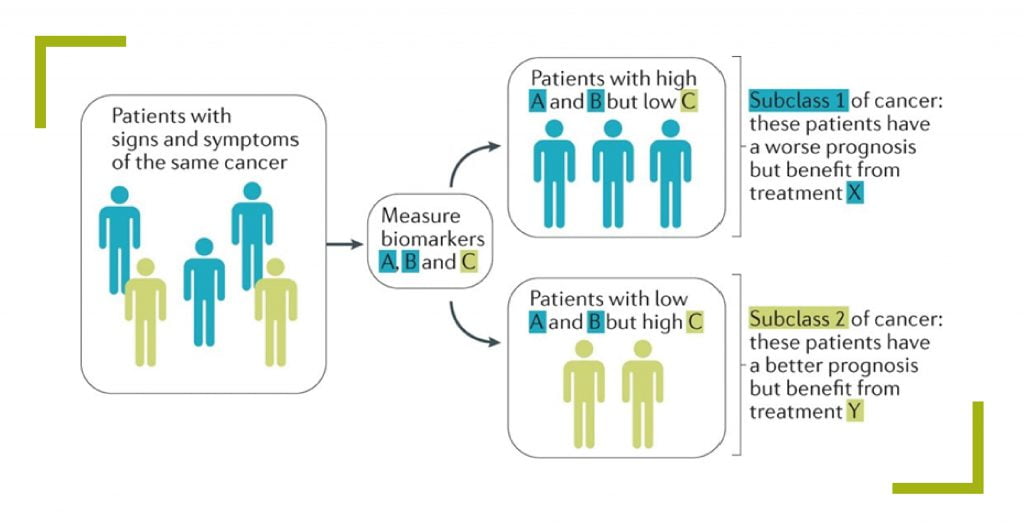
نقش بیومارکرها:
تشخیص همراه (CDx) با شناسایی بیومارکرهای پیشبینیکننده به طبقهبندی بیماران، شناسایی افرادی که شانس بیشتری برای پاسخ به درمان دارند و شناسایی افرادی که عوارض جانبی بیشتری نشان میدهند، میپردازد. بنابراین CDx نقش مهمی در توسعه داروهای مؤثرتر و ایمنتر دارد و بخش مهمی از Personal medicine و Precision medicine است.
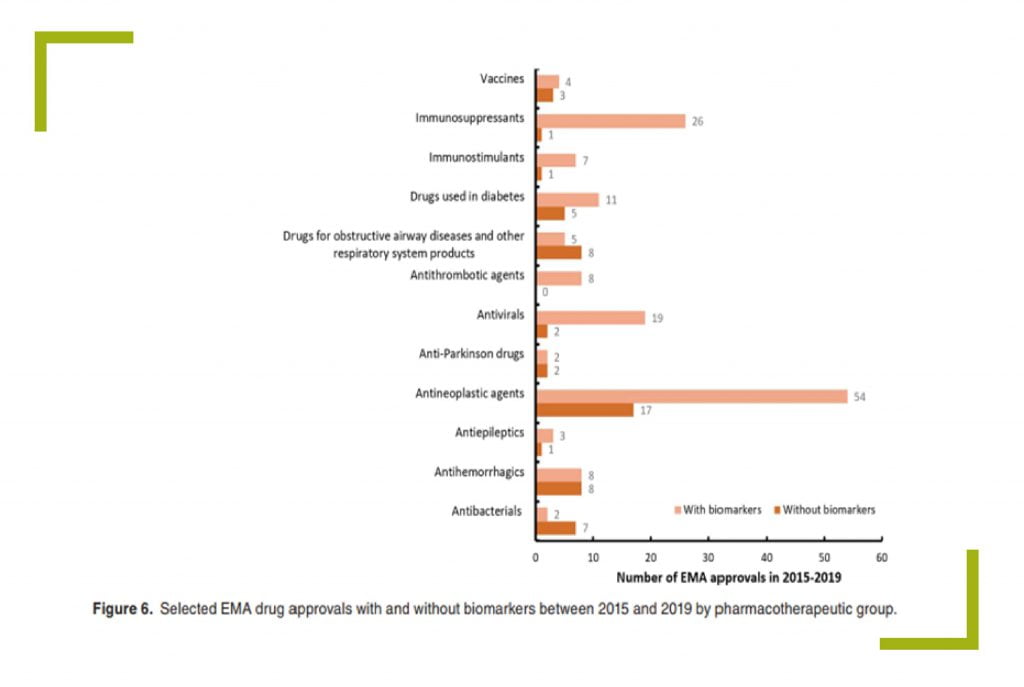
نشانگرهای زیستی این پتانسیل را دارند که فرآیندهای کشف، توسعه و تأیید دارو را کارآمدتر کنند. نمودار زیر درصد داروهایی که از بیومارکرها بهره بردهاند را در بین سال های 2015 تا 2019 نشان داده است. این داروها در مقایسه با داروهای بدون بیومارکر، توانستهاند بیشتر تاییدیههای لازم را بگیرند.
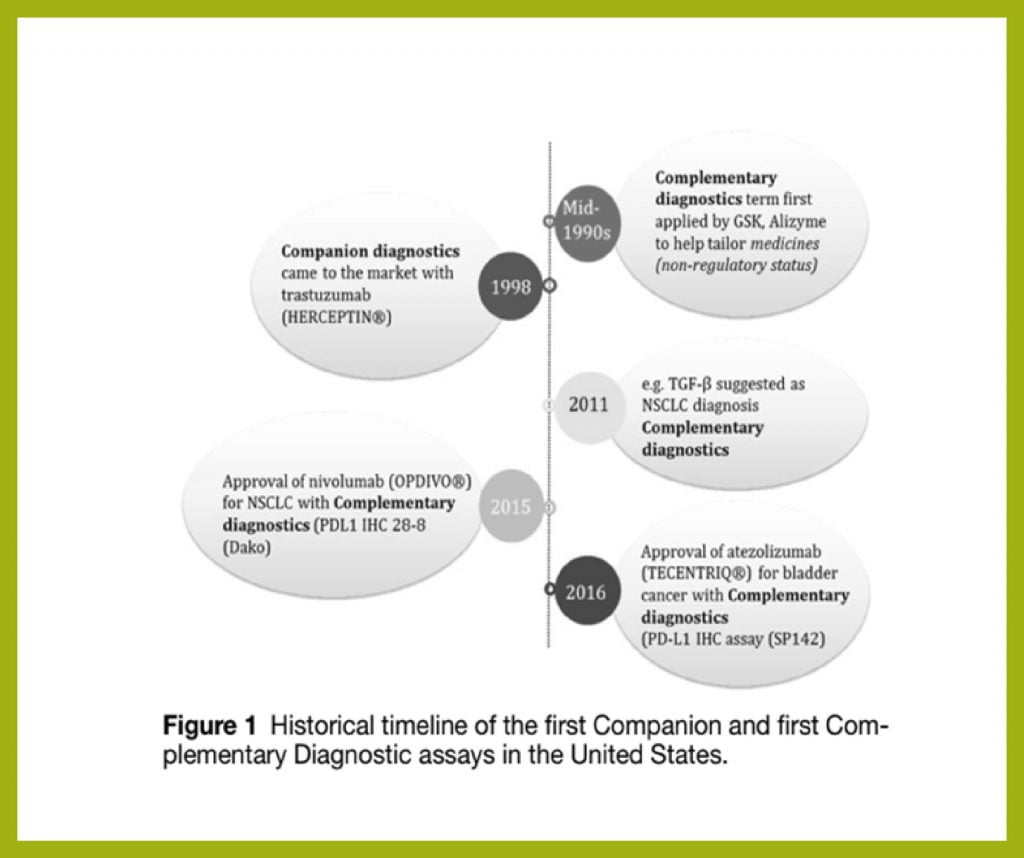
اولین نشانگر زیستی پیشبینیکننده مرتبط با توسعه دارو، پروتئین HER2 بود که منجر به تایید دارو Herceptin® (trastuzumab) و تست ایمونوهیستوشیمی HER2 شد که درنتیجه آن. FDA اولین تشخیص همراه (آزمایش HER2 برای تراستوزوماب) را در سال 1998 و اولین تشخیص تکمیلی (آزمایش PD-L1 IHC برای نیولوماب) را در سال 2015 تایید کرد. اگرچه اصطلاح “تشخیص مکمل” از دهه 1990 استفاده شد که تا سال 2015 اعمال نمیشد.
در مسیر توسعه این همکاریها، روشهای درمانی مشخصی روی کار آمدند که تا پیش از این ناشناخته بودند. و صنعت درمان به سوی تخصصیتر شدن سوق داده شد و ایده تولید داروهای مشخصی شکل گرفت.
هنگامی که تست COBAS BRAF V600E و دارو vemurafenib (ZELBORAF) برای درمان ملانومای متاستاتیک تاییدیه FDA را به طور همزمان گرفتند. تولیدکنندگان به فکر توسعه موازی دارو و سنجش مرتبط با آن افتادند. تایید همزمان این دو مثال مهمی از یک همکاری داروی توسعهیافته و روش تشخیصی بود.
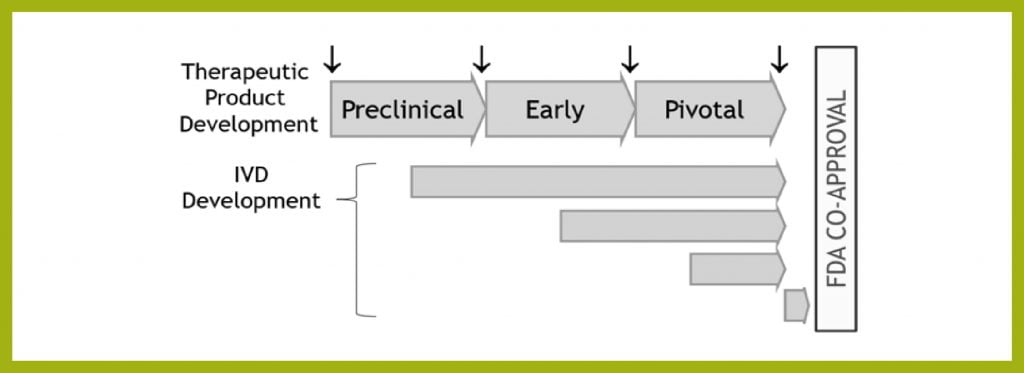
توسعه مشترک
صنعت IVD در تمام مراحل طراحی و تولید دارو قادر به ایجاد همکاری با صنعت داروسازی است. بنابراین فرآیند توسعه مشترک محصول درمانی در هر مرحلهای قابل اجراست. اما باید به گونهای انجام شود که دریافت مجوزهای بازاریابی همزمان برای محصول درمانی و تشخیص همراه (IVD) را تسهیل کند.
شباهت های مسیر پیشبرد داروسازی و صنعت تشخیص:
نقاط حیاتی فرآیند توسعه مشترک:
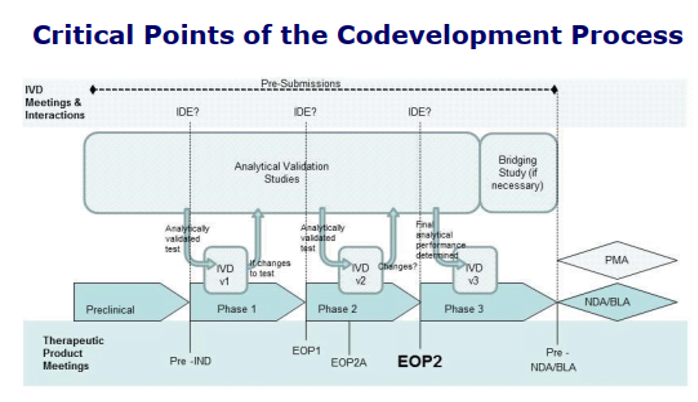
در روند توسعه دو صنعت، فازهای اجرایی مشترکی وجود دارد که گذراندن آنها برای گرفتن تاییدیههای سازمان غذا و دارو ضروری است. نقاط حیاتی در توسعه دو صنعت به گونهای تعریف شدهاند که بتوانند برنامهای منظم در جهت همراهسازی این دو ارائه دهند. در واقع FDA برای توسعه مشترک مسیر مشخصی را پیشنهاد دادهاست. که هم حافظ منافع دو صنعت باشد و هم بهترین نتیجه درمانی را در جامعه رقم بزند. مشخص شدهاست که مفهوم معاصر داروی همراه با تشخیص که مبتنی بر شناسایی بیماران با احتمال بیشتر پاسخ به یک داروی خاص است. هزینههای کلی مراقبتهای بهداشتی را به دلیل مدیریت هدفمند بیمار کاهش میدهد. نمونههایی از داروهای همراه با تشخیص تایید شده توسط سازمان غذا و دارو که گویای این مسئله هستند. شامل دارو cetuximab برای درمان سرطان متاستاتیک کولورکتال (metastatic colorectal cancer)، دارو imatinib برای درمان تومور استرومای دستگاه گوارش و دارو vemurafenib برای درمان ملانوما در مراحل آخر (late-stage melanoma) میباشد.
ارزشگذاریIVD
مقامات بهداشتی در چند دهه اخیر به طور فزایندهای به دنبال دریافت مدارکی هستند. که نشان دهد آزمایشهای تشخیصی نه تنها قیمت مناسبی دارند، بلکه ارزش قابلتوجهی به جامعه میافزایند. این نوع همکاریها میتواند به کشف ارزشهای قابل توجهی بینجامد. بسیاری از کارشناسان چارچوبهایی را معرفی میکنند که چگونه میتوان ارزش تشخیص آزمایشگاهی را به بهترین نحو ارزیابی کرد. اساساً ارزش IVD ممکن است به صورت زیر تعریف شود:
عملکرد (Performance) بر اساس قابلیت اطمینان و تکرارپذیری نتیجه، در کمترین زمان چرخهای بدست میآید. بهرهوری ( Efficiency ) از درصد تصمیمات مطلوب بالینی نسبت به هزینهها به دست میآید. به طور کلی عملکرد دستگاههای تست IVD در سراسر صنعت تشخیصی نسبتاً قابل مقایسه است. مؤلفه کارایی متمایزکننده اصلی است و ارزش درمانی آن را مشخص میکند. در سال 2005، گزارشی توسط گروه لوین (Lewin) نشان داد که روشهای تشخیصی، کمتر از 5 درصد هزینههای بیمارستانی و تقریباً 6/1 درصد از کل هزینههای درمانی را شامل میشوند. در حالی که 60 تا 70 درصد تصمیمات بالینی را پوشش میدهند. بنابراین IVD ها را میتوان یک اقدام مقرون به صرفه برای به حداکثر رساندن نتایج درمان در نظر گرفت. صنعت IVD میتواند هزینههای مستقیم و غیرمستقیم مراقبتهای بهداشتی را کاهش دهد. نتایج بالینی بهتری ایجاد کند و در نتیجه ارزش پزشکی، دارویی و به طور کلی درمانی، ایجاد کند.
رفرنس ها:
https://doi.org/10.1111/cts.12455
https://doi.org/10.1177/1177271920974
http://af.trustarpack.com/info/pharmaceutical-instruments-the-ultimate-guide-39060796.html
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4397716
https://www.futuremedicine.com/doi/full/10.2217/pme.12.60
https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0149856
https://www.tga.gov.au/publication/ivd-companion-diagnostics
برچسب ها : |
مرتبط با مطلب بالا :
